
Учёные рассказали об иммунных различиях и лекарствах будущего.

В 2009 году канадский психолог-бихевиорист Роберт Сордж (Robert Sorge) изучал, как у животных формируется гиперчувствительность к прикосновениям при хронической боли. Для этого в одном экспериментеSpinal Cord Toll-Like Receptor 4 Mediates Inflammatory and Neuropathic Hypersensitivity in Male But Not Female Mice лапки мышей кололи тонкими волосками.
Самцы тут же отдёргивали лапы, а самки как будто ничего не чувствовали. Это поставило исследователей в тупик. Они продолжали эксперименты, пока не пришли к выводу, что такая реакция — следствиеDifferent immune cells mediate mechanical pain hypersensitivity in male and female mice совершенно разных путей болевой чувствительности у самцов и самок.
Обычно в исследованиях болевых ощущений использовали только мышей-самцов. Считалось, что колебания гормонального уровня самок излишне усложнят результаты. Сордж же был одним из тех, кто не последовал этому правилу.
У нас разные пути болевой чувствительности
Мы чувствуем боль, когда рецепторы на коже, в мышцах, суставах или органах регистрируют потенциально опасное ощущение. Например, высокую температуру или повреждение тканей. Они посылают сигнал по периферическим нервам к спинному мозгу, а затем к коре головного мозга, которая интерпретирует эти сигналы как «больно!».
Хотя со стороны вся боль выглядит одинаково, нельзя считать, что в её формировании у всех задействованы одни и те же процессы.
Боль многообразна. Бывает экстренная реакция на что-то горячее или острое, а бывает хроническая боль, не проходящая даже после заживления травмы. Она проявляется как гиперчувствительность к стимулам, которые обычно не вызывают болезненных ощущения.
Так и было в случае с мышами Сорджа. В 2009 году он вместе с Джеффри Могилом (Jeffrey Mogil), специалистом по поведенческой неврологии, изучал хроническую боль, вызванную воспалением. Они ввели в спинной мозг мышей молекулу липополисахарида — это один из компонентов бактериальных клеток.
Молекула привлекла внимание микроглий — иммунных клеток нервной системы. Но воспаление возникло только у самцов — у самок микроглии не активизировались. Именно из-за этой разницы самцы были так чувствительны к покалываниям тонкими волосками, а самки его как будто не замечали.
Затем Сордж и Могил повредили седалищный нерв мышей обоих полов. Это привело к хронической боли, которая обычно возникает, когда система выявления боли в организме повреждена или работает неправильно. И самцы, и самки стали гиперчувствительны к прикосновениям. Но различия всё равно были.
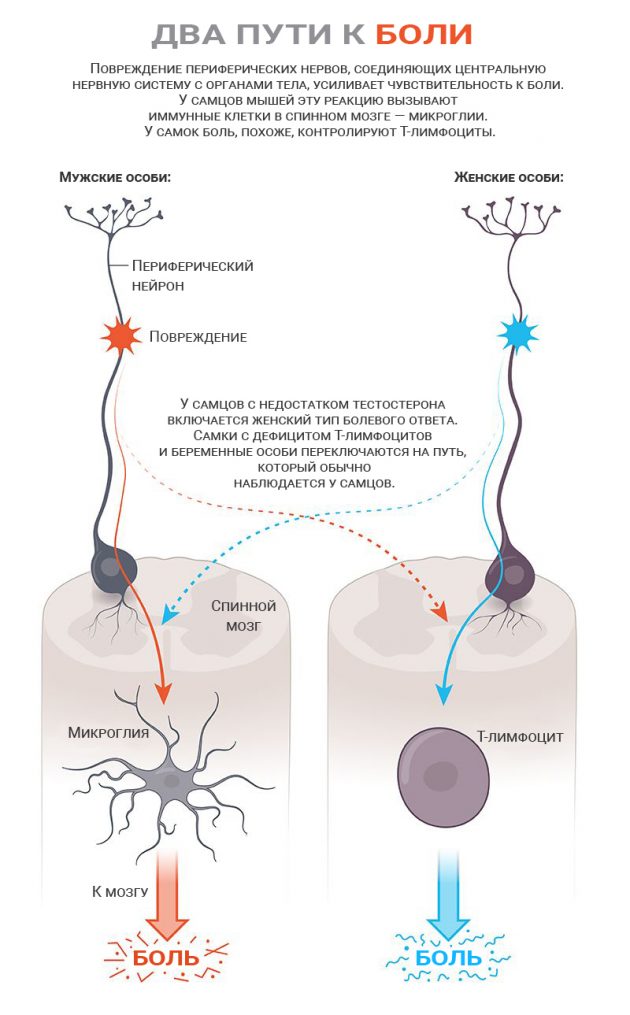
В предыдущем эксперименте выяснилось, что у самцов важную роль в восприятии боли играют микроглии. И если их заблокировать, чувствительность к боли снижается. Но у самок всё обстоит не так. Как бы исследователи не блокировали их микроглии, чувствительность к боли оставалась высокой. ОказалосьDifferent immune cells mediate mechanical pain hypersensitivity in male and female mice, что в их организме за хронической болью стоит другой компонент иммунной системы — Т-лимфоциты.
Сордж проверил это на самках с аналогичными повреждениями нервов, но с дефицитом Т-лимфоцитов. Они тоже стали гиперчувствительны к прикосновению тонких волосков, но теперь в восприятие боли включились микроглии. То есть животные переключились на «мужской» тип болевой чувствительности.
Если у этих самок блокировали активность микроглий, реакция исчезала — точно так же, как у самцов. А когда учёные обратно ввели самкам Т-лимфоциты, они перестали задействовать микроглии — переключились обратно на «женский» тип.
На восприятие влияет тестостерон
Возникает вопрос: что контролирует переключение между разными путями болевой чувствительности. Исследователи давно приписывали разницу в восприятии боли эстрогену. Этот гормон контролирует формирование матки, яичников и молочных желёз, а также регулирует менструальный цикл. Эстроген может усиливать и приглушать боль в зависимости от концентрации в организме.
Но вот тестостерону раньше уделяли мало внимания.
Работы Могила явно указывают на то, что именно тестостерон переключает болевые пути. Когда они с Сорджем кастрировали мышей-самцов (что снизило уровень тестостерона), реакция животных оказывалась такой же, как у самок. А когда учёные вводили тестостерон самкам и кастрированным самцам, путь болевой чувствительности переключался на «мужскую» версию, то есть задействовал микроглии.
Гораздо сложнее проверить, как работают пути болевой чувствительности у людей, но появляются первые сведения. Нейрофармаколог Тед Прайс (Ted Price) обнаружилElectrophysiological and transcriptomic correlates of neuropathic pain in human dorsal root ganglion neurons, что у людей на восприятие боли тоже влияют иммунные клетки. Он с коллегами изучил нервные ткани больных раком, у которых опухоль затронула спинной мозг.
В нервах, которые вырезали у мужчин, обнаружили следы воспаления, вызванного иммунными клетками макрофагами. По функциям они близки к микроглиям. У женщин же более важную роль в восприятии боли выполняют сами нервные клетки и короткая цепочка аминокислот, стимулирующая рост нервной ткани. Это наводит на мысль о том, что мужчинам и женщинам могут быть нужны разные лекарства.
На нас неодинаково действуют медикаменты
В 2018 году Прайс обнаружилThe antidiabetic drug metformin prevents and reverses neuropathic pain and spinal cord microglial activation in male but not female mice, что лекарство от диабета метформин снижает количество микроглий вокруг сенсорных нейронов в спинном мозге. А также то, что он блокирует гиперчувствительность к боли только у мышей-самцов, но самкам никак не помогает.
Прайс высказал гипотезу, которая объясняет такие различия: метформин попадает в нервную систему с помощью белка, который в больших количествах экспрессируется в мужских клетках. Увеличение дозы метформина не помогает самкам, потому что лекарство не может попасть в нервные ткани.
Однако увеличение дозы помогает в другом случае — с морфином.
«И женщинам, и самкам грызунов для снятия боли обычно требуется более высокая доза морфина, чем представителям мужского пола», — говорит Энн Мёрфи (Anne Murphy), нейроучёный из Государственного университета Джорджии в Атланте. Она — одна из немногих исследователей, которые давно изучают половые различия в восприятии боли.
В 2017 году она с коллегами обнаружилаSex Differences in Microglia Activity within the Periaqueductal Gray of the Rat, что в разном действии морфина тоже повинны микроглии. Морфин притупляет боль, блокируя нейроны в области мозга под названием околоводопроводное серое вещество (ОСВ). Но ещё он может активировать микроглии в этой области, что нейтрализует обезболивающий эффект. Именно это происходит с крысами-самками, потому что у них больше активных микроглий в ОСВ, чем у самцов.
В эксперименте Мёрфи всем крысам дали морфин, а затем стали нагревать поверхность под задними лапами животных. Так как у крыс-самок больше микроглий в ОСВ, у них в этой области происходило больше воспалительных процессов.
В результате повысилась их чувствительность к боли и они быстрее отдёргивали лапы, чем самцы, получившие такую же дозу вещества. Когда исследователи ликвидировали влияние морфина на микроглии, самцы и самки стали одинаково реагировать на болевой стимул.
И разница в действии лекарств касается не только мышей.
Сейчас на рынке уже есть по меньшей мере один препарат, по-разному действующий на мужчин и женщин. Это средство для предотвращения мигрени, выпущенное в 2018 году. Оно включает антитела к кокальцигенину — белку, который играет важную роль в развитии приступов. Известно, что от мигрени чаще страдаютSex Matters: Evaluating Sex and Gender in Migraine and Headache Research женщины — их в три раза больше, чем мужчин с этим заболеванием.
Прайс провёл экспериментDural calcitonin gene-related peptide produces female-specific responses in rodent migraine models с кокальцигенином. Он ввёл это вещество в твёрдую мозговую оболочку мышей. У самок белок вызвал симптомы, похожие на мигрень: они морщились, а их мордочки стали гиперчувствительны к прикосновениям. У самцов же симптомы не появились.
Это значит, что у них мигрень может быть вызвана другими факторами. Вероятно, лекарства, блокирующие кокальцигенин, не так эффективны для мужчин. Но во время клинических испытаний препарата этого не проверяли.
И это довольно распространённая ситуация. В клинических испытаниях лекарств обычно участвуют мужчины и женщины, но их количество недостаточно, чтобы выявить различия. Вполне возможно, что некоторые обезболивающие, которые провалили испытания, могли бы оказаться успешными, если бы их тестировали, учитывая половые различия.
И это должно отразиться на производстве обезболивающих
Сегодня фармацевтические компании предлагают одинаковые лекарства для всех, но это может измениться. Пока довольно сложно создать препараты специально для того или иного пола. На ранних стадиях клинических испытаний безопасность ценится превыше всего, поэтому компании исключают женщин репродуктивного возраста. В результате лекарства чаще всего тестируют на мужчинах и на женщинах после менопаузы.
Но даже если разработают лекарства отдельно для мужского и женского путей болевой чувствительности, этого может быть недостаточно. В течение жизни людям могут быть нужны разные обезболивающие, в зависимости от колебаний гормонального фона. Кроме того, пол человека не всегда чётко укладывается в категории мужского или женского. Его определяет совокупность факторов: генетика, анатомическое развитие, уровни гормонов.
Каждый из этих факторов может повлиять на то, какое обезболивающее подойдёт человеку.
Пока очень мало известно о механизмах боли у людей, которые не вписываются в рамки бинарной гендерной системы. В одном исследовании учёные из Италии опросилиCross-sex hormone administration changes pain in transsexual women and men трансгендерных участников, проходящих гормональную терапию. 11 из 47 людей, совершивших переход от мужского к женскому полу, отметили появление болевых симптомов. Шесть из 26 участников, совершающих переход от женского к мужскому полу, сообщили, что их болевые ощущение сократились после принятия тестостерона.
Сейчас у учёных недостаточно результатов, а большинство выводов основано на исследовании грызунов. Однако они предполагают, что лекарства будущего станут учитывать индивидуальные характеристики потребителей. Могил считает, что пути болевой чувствительности, а значит и выбор обезболивающего в будущем, зависят от уровня гормонов. У людей с уровнем тестостерона выше определённой границы активизируется «мужской» путь болевой чувствительности. А у тех, чей уровень этого гормона ниже границы, — «женский».
Читайте также








